うつ病は、米国で最も一般的なメンタルヘルスの問題のXNUMXつです。 現在の研究では、うつ病は遺伝的、生物学的、生態学的、心理的側面の組み合わせから生じることが示唆されています。 うつ病は世界中の主要な精神障害であり、社会に重大な経済的および心理的負担をかけています。 幸いなことに、最も重症の場合でも、うつ病は治療される可能性があります。 早期に治療を開始できるほど、より効果的です。
しかし、結果として、障害のある各患者の薬物および/または薬物発見プロセスを加速するために、診断を改善するのに役立つ強力なバイオマーカーが必要です。 これらは、うつ病の発症または存在の確率を予測し、重症度または症候学に従って層別化し、予測および予後を示し、または治療的介入に対する反応を監視するために存在を使用できる客観的な末梢生理学的指標である。 次の記事の目的は、さまざまな発見に関する最近の洞察、現在の課題、および将来の展望を示すことです。 バイオマーカー うつ病と、これらが診断と治療の改善にどのように役立つかについて。
うつ病のバイオマーカー:最近の洞察、現在の課題、および将来の展望
抽象
多数の研究がうつ病の何百もの推定バイオマーカーを示唆していますが、うつ病におけるそれらの役割を完全に解明したり、患者の異常と診断、治療、および予後を強化するために生物学的情報をどのように使用できるかを確立していません。 この進歩の欠如は、研究文献内の方法論的不均一性および可能性のある多数のバイオマーカーと関連して、うつ病の性質および不均一性に部分的に起因し、その発現は多くの要因によってしばしば変化します。 炎症、神経栄養および代謝プロセス、ならびに神経伝達物質および神経内分泌系の構成要素に関与するマーカーが非常に有望な候補であることを示す利用可能な文献をレビューします。 これらは、遺伝的および後成的、トランスクリプトミクスおよびプロテオミクス、メタボロミクスおよび神経画像の評価を通じて測定することができます。 治療への反応を予測し、特定の治療に対する患者を層別化し、新しい介入の標的を開発するためにバイオマーカーを使用できるかどうか、またどのバイオマーカーを使用できるかを判断するには、新しいアプローチと体系的な研究プログラムの使用が必要です。 これらの研究手段をさらに発展させ、拡大することにより、うつ病の負担を軽減することは大いに期待できると私たちは結論付けています。
キーワード: 気分障害、大うつ病性障害、炎症、治療反応、層別化、個別化医療
概要
メンタルヘルスと気分障害の課題
精神医学は他のどの医療診断カテゴリーよりも病気に関連する負担が大きいですが1、研究資金2や出版物を含む多くの領域で身体的健康と精神的健康の間で尊敬の格差が依然として明らかです3。精神的健康が直面する困難の中には欠如がありますこれらの障害の根底にあるプロセスの不完全な理解から生じる分類、診断および治療を取り巻くコンセンサスの。 これは、メンタルヘルスの最大の負担となるカテゴリーである気分障害で非常に明白です。3最も一般的な気分障害である大うつ病性障害(MDD)は、患者の最大60%が経験する可能性のある複雑で不均一な病気です。気分障害の場合、およびメンタルヘルスのより広い分野では、治療結果は、診断カテゴリー内(および全体)の堅牢で均質なサブタイプの発見によって改善される可能性があります。層別化することができます。 これを認識して、研究領域基準など、機能的サブタイプを描写するための世界的なイニシアチブが現在進行中です4。生物学的マーカーは精神障害のサブタイピングの優先候補であると考えられています5。
うつ病の治療に対する反応の改善
大うつ病の治療選択肢は多岐にわたりますが、コンセンサスガイドラインに従って最適な抗うつ治療を受け、測定ベースのケアを使用した場合でも、MDD患者の約7分の8,9のみが寛解を達成し、治療反応率は新しい治療ごとに低下するようです。 .4さらに、治療抵抗性うつ病(TRD)は、機能障害、死亡率、罹患率、および長期的な再発または慢性エピソードの増加と関連しています50。したがって、あらゆる臨床段階で治療反応を改善することで、うつ病の全体的な結果。 TRDに起因する大きな負担にもかかわらず、この分野の研究はまばらです。 以前の試みにもかかわらず、TRDの定義は標準化されていません:4,10いくつかの基準は、9,11%の症状スコアの減少を達成できないXNUMXつの治療試験のみを必要としますが、他の基準は完全寛解の未達成を必要としますまたは、TRDと見なされるエピソード内の異なるクラスの少なくともXNUMXつの適切に試行された抗うつ薬に対する無反応XNUMXさらに、治療抵抗性の病期分類と予測は、失敗した治療の数に重症度と慢性の主要な臨床的特徴を追加することによって改善されます.XNUMXそれにもかかわらず、この定義の不一致は、TRDに関する研究文献の解釈をさらに複雑な作業にします。
治療への反応を改善するために、無反応の予測危険因子を特定することは明らかに役に立ちます。 以前のエピソード後の完全な寛解の欠如、併存する不安、自殺傾向、うつ病の早期発症、性格(特に低外転、低報酬依存、高神経症)、遺伝的要因など、TRDのいくつかの一般的な予測因子が特徴づけられています12。これらの発見は、うつ病の薬理学的治療と心理学的治療13のエビデンスを別々にまとめたレビューによって裏付けられています。 抗うつ薬と認知行動療法はほぼ同等の有効性を示します14が、作用機序が異なるため、反応の予測因子が異なると予想される場合があります。 若年期のトラウマは長い間、臨床転帰の悪化と治療への反応の低下と関連してきましたが15、初期の適応症は、小児期のトラウマの病歴を持つ人々が薬物療法よりも心理的治療によく反応する可能性があることを示唆しています16。治療の層別化は臨床診療に達しています17。
このレビューは、うつ病の治療反応を強化するための潜在的に有用な臨床ツールとしてのバイオマーカーの有用性を支持する証拠に焦点を当てています。
バイオマーカー:システムとソース
バイオマーカーは、さまざまな介入に対する反応の予測因子を特定するための潜在的なターゲットを提供します19。これまでの証拠は、炎症、神経伝達物質、神経栄養、神経内分泌および代謝系の活動を反映するマーカーが、現在うつ病の個人の精神的および肉体的健康の結果を予測できる可能性があることを示唆しています、しかし、調査結果の間には多くの矛盾があります。20このレビューでは、これらのXNUMXつの生物学的システムに焦点を当てます。
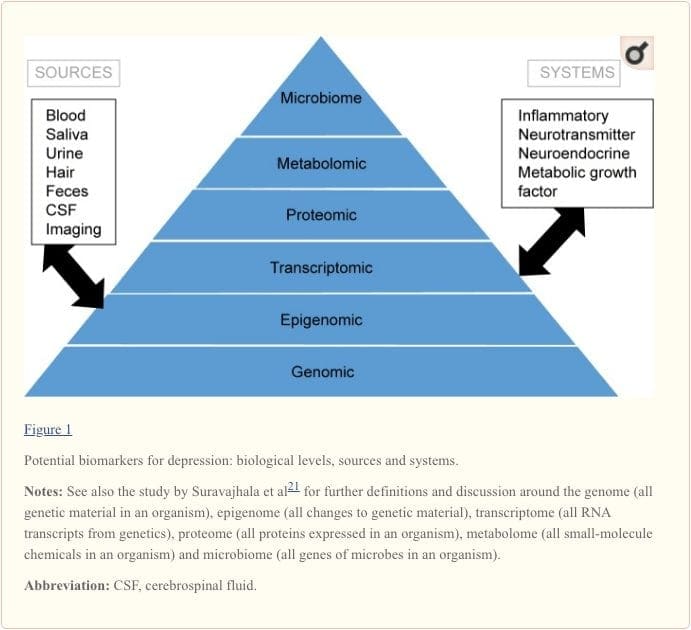
分子経路と精神障害におけるそれらの寄与を完全に理解するために、現在、一般に「オミクス」アプローチと呼ばれる複数の生物学的「レベル」を評価することが重要であると考えられています21。 1つのシステムのそれぞれを評価できる生物学的レベル、およびこれらの評価を行うことができるマーカーの潜在的なソース。 ただし、各システムは各オミクスレベルで検査できますが、最適な測定ソースは各レベルで明らかに異なることに注意してください。 たとえば、ニューロイメージングは脳の構造や機能を間接的に評価するためのプラットフォームを提供し、血液中のタンパク質検査はマーカーを直接評価します。 トランスクリプトミクス22とメタボロミクス23はますます人気があり、潜在的に膨大な数のマーカーの評価を提供し、ヒトマイクロバイオームプロジェクトは現在、ヒト内のすべての微生物とその遺伝的組成を特定しようとしています24。 ; たとえば、コルチゾールなどのホルモンは、血液、脳脊髄液、尿、唾液だけでなく、髪や指の爪(慢性的な指標を提供)または汗(継続的な測定を提供)25で分析できるようになりました。
うつ病に関与する推定上の情報源、レベル、およびシステムの数を考えると、翻訳の可能性があるバイオマーカーの規模が広範囲にわたることは驚くべきことではありません。 特に、マーカー間の相互作用を考慮すると、単一のバイオマーカーを単独で調べることで、臨床診療を改善するための有益な結果が得られる可能性は低いでしょう。 Schmidt et al26は、バイオマーカーパネルの使用を提案し、その後、Brand et al27は、MDDの以前の臨床および前臨床エビデンスに基づいて、16の「強力な」バイオマーカーターゲットを特定するドラフトパネルの概要を示しました。 それらは、灰色物質量の減少(海馬、前頭前野皮質および大脳基底核領域)、サーカディアンサイクルの変化、コルチゾール過剰症、および視床下部-下垂体-副腎(HPA)軸の活動亢進、甲状腺機能障害、ドーパミンの減少、ノルアドレナリンまたは5-ヒドロキシインドール酢酸のその他の表現を含みます、グルタミン酸の増加、スーパーオキシドジスムターゼおよび脂質過酸化の増加、環状アデノシン3?、5?-一リン酸およびマイトジェン活性化プロテインキナーゼ経路活性の減弱、炎症誘発性サイトカインの増加、トリプトファン、キヌレニン、インスリンおよび特定の遺伝的多型への変化。 これらのマーカーはコンセンサスによって合意されておらず、さまざまな方法で測定できます。 それらの臨床的利益を証明するために、集中的かつ体系的な作業がこの巨大な課題に対処しなければならないことは明らかです。
このレビューの目的
意図的に広範なレビューとして、この記事は、うつ病におけるバイオマーカー研究の全体的なニーズと、バイオマーカーが治療への反応を高めるための真のトランスレーショナルポテンシャルを保持する程度を決定しようとしています。 この分野で最も重要でエキサイティングな発見について議論することから始め、関連するマーカーと比較に関連するより具体的なレビューに読者を導きます。 うつ病の負担を軽減する必要性と組み合わせて、証拠に照らして直面している現在の課題の概要を説明します。 最後に、現在の課題に対処するための重要な研究経路と、それらが臨床診療に与える影響を楽しみにしています。
最近の洞察
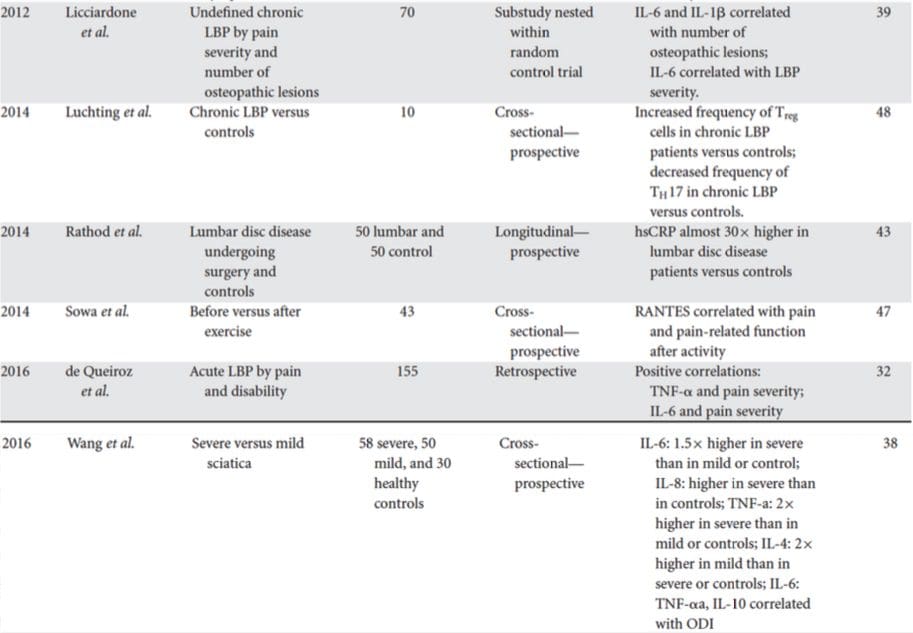
うつ病の人々のための臨床的に有用なバイオマーカーの検索は、過去半世紀にわたって広範な調査を生み出してきました。 最も一般的に使用される治療法は、うつ病のモノアミン理論から考案されました。 その後、神経内分泌仮説が大きな注目を集めました。 より最近では、最も多くの研究がうつ病の炎症性仮説を取り囲んでいます。 ただし、関連する総説の多くは、1つのシステムすべてに焦点を当てています。 バイオマーカーシステム全体の最近の洞察のコレクションについては、表XNUMX以下を参照してください。 多くのレベルで測定されていますが、血液由来タンパク質は最も広く検査されており、便利で費用効果が高く、他のソースよりも翻訳の可能性に近い可能性のあるバイオマーカーのソースを提供します。 したがって、血液中を循環するバイオマーカーについてより詳細に説明します。
最近の系統的レビューで、Jani et al20は、治療結果に関連して、うつ病の末梢血ベースのバイオマーカーを調べました。 含まれている14の研究(2013年初頭まで検索)のうち、36のバイオマーカーが研究され、そのうち12は少なくとも12つの調査で精神的または身体的反応指数の有意な予測因子でした。 無反応の危険因子を表す可能性があると特定されたものには、炎症性タンパク質が含まれていました。低インターロイキン(IL)-70p100、リンパ球と単球の比率。 神経内分泌マーカー(コルチゾールのデキサメタゾン非抑制、高循環コルチゾール、甲状腺刺激ホルモンの低下); 神経伝達物質マーカー(低セロトニンおよびノルアドレナリン); 代謝(低高密度リポタンパク質コレステロール)および神経栄養因子(S19,28カルシウム結合タンパク質Bの減少)。 これに加えて、他のレビューでは、追加のバイオマーカーと治療結果との関連について報告されています。30各システムの推定マーカーの簡単な説明は、後続のセクションと表2に概説されています。
うつ病の炎症性所見。
マクロファージの仮説を概説したスミスの独創的な論文31以来、この確立された文献は、うつ病患者のさまざまな炎症誘発性マーカーのレベルの上昇を発見し、広くレビューされています32。37の炎症性タンパク質が、うつ病と健康を比較するメタアナリシスで評価されています。対照集団38
IL-6(すべてのメタアナリシスでP <0.001、31件の研究を含む)およびCRP(P <0.001、20件の研究)は、うつ病で頻繁かつ確実に上昇しているようです40。初期の研究では、腫瘍壊死因子α(TNF?)の上昇が確認されました。 (P <0.001)、38しかし、より最近の調査(31件の研究)を説明する場合、実質的な不均一性により、これは決定的ではありませんでした。40IL-1? メタアナリシスはうつ病のレベルが高いことを示唆しており(P = 0.03)41、ヨーロッパの研究でのみ高いレベルである42か、対照との違いはない40。 1?、44は、IL-1の上昇の非常に重要な効果によってサポートされていますか? 抗うつ薬に対する反応不良を予測するリボ核酸;上記の45の他の所見は、循環血液由来サイトカインに関するものです。 ケモカイン単球化学誘引物質タンパク質-1は、39つのメタ分析でうつ病の参加者の上昇を示しました2。インターロイキンIL-4、IL-8、IL-10、IL-8、およびインターフェロンガンマは、うつ病の患者と対照の間で有意差はありませんでした。メタ分析レベルですが、それでも治療による変化の可能性を示しています:IL-46は、治療中のIL-10とインターフェロンガンマの変化の47の異なるパターンで、前向きかつ断面的に重度のうつ病の患者で上昇していると報告されています早期応答者と非応答者の間で発生しました4が、IL-2とIL-48は症状の寛解に沿って減少しました6。メタ分析では、IL-1、IL-10?、IL-の治療に伴うわずかな減少が示されています。 43,49,50およびCRP.43さらに、TNF? レスポンダーでの治療によってのみ減少する可能性があり、複合マーカーインデックスは、その後治療に反応しない患者の炎症の増加を示す可能性があります51。ただし、炎症性タンパク質と治療反応を調べる研究のほとんどすべてが薬理学的治療試験を利用していることは注目に値します。 したがって、治療中の少なくともいくつかの炎症性変化は、抗うつ薬に起因する可能性があります。 さまざまな抗うつ薬の正確な炎症効果はまだ確立されていませんが、CRPレベルを使用した証拠は、ベースラインの炎症に基づいて特定の治療に対して個人が異なる反応を示すことを示唆しています:Harley et al52は、心理療法(認知行動療法または対人療法)に対する反応の悪さを予測する治療前CRPの上昇を報告しました心理療法)、しかしノルトリプチリンまたはフルオキセチンへの良好な反応; Uher et al53は、ノルトリプチリンについてこの発見を再現し、エスシタロプラムについては反対の効果を特定しました。 対照的に、Chang et al54は、フルオキセチンまたはベンラファキシンに対する初期の応答者において、非応答者よりも高いCRPを発見しました。 さらに、TRDと高CRPの患者は、TNFに対してよりよく反応しましたか? 正常範囲のレベルのものよりも拮抗薬インフリキシマブXNUMX
まとめると、証拠は、ボディマス指数(BMI)や年齢などの要因を制御する場合でも、うつ病患者の約55,56分の1で炎症反応が異常に見えることを示唆しています1。しかし、炎症系は非常に複雑であり、このシステムのさまざまな側面を表す多数のバイオマーカーがあります。 最近、追加の新規サイトカインおよびケモカインがうつ病の異常の証拠をもたらしました。 これらには、マクロファージ阻害タンパク質7a、IL-12a、IL-70、IL-13p15、IL-57、IL-5,58、エオタキシン、単球マクロファージコロニー刺激因子、16,59 IL-17,60 IL-4,61IL-が含まれます。 62単球化学誘引物質タンパク質-3胸腺および活性化調節ケモカイン、63エオタキシン-10,64、TNFb、65インターフェロンガンマ誘導タンパク質66血清アミロイドA、1.67可溶性細胞内接着分子XNUMXおよび可溶性血管細胞接着分子XNUMX
うつ病における成長因子の所見
非神経栄養性成長因子(血管新生に関連するものなど)の潜在的な重要性に照らして、成長因子のより広い定義の下で神経原性バイオマーカーを参照します。
脳由来神経栄養因子(BDNF)は、これらの中で最も頻繁に研究されています。 複数のメタ分析は、抗うつ薬治療とともに増加するように見える血清中のBDNFタンパク質の減衰を示しています68。71これらの分析の最新のものは、これらのBDNF異常が最も重度のうつ病患者でより顕著であることを示唆していますが、抗うつ薬は臨床的寛解がない場合でもこのタンパク質のレベルを上昇させます70。proBDNFは成熟型のBDNFほど広く研究されていませんが、72つは機能的に(チロシン受容体キナーゼB受容体への影響に関して)異なるようです。証拠は、成熟したBDNFがうつ病で減少する可能性がある一方で、proBDNFが過剰産生される可能性があることを示唆しています73。より重度のうつ病の患者で最も弱毒化されています74。グリア細胞のメタ分析でも同様の所見が報告されています系統由来の神経栄養因子XNUMX
血管内皮増殖因子(VEGF)は、VEGFファミリーの他のメンバー(例、VEGF-C、VEGF-D)とともに血管新生および神経新生を促進する役割を果たし、うつ病の可能性があります75。一貫性のない証拠にもかかわらず、16つのメタ分析には最近、対照と比較したうつ病患者の血液中のVEGFの上昇が示された(0.001件の研究全体; P <76,77)78しかし、TRD79では低VEGFが同定されており、より高いレベルでは抗うつ薬治療に対する無反応が予測されています80。なぜVEGFタンパク質のレベルが上昇するのか、しかしそれは部分的に炎症誘発性活性および/または脳脊髄液の発現低下を引き起こす鬱状態での血液脳バリア透過性の増加に起因する可能性があります81。VEGFと治療反応の関係は不明です; 最近の研究では、抗うつ薬治療とともに減少するにもかかわらず、血清VEGFまたはBDNFと反応またはうつ病の重症度との間に関係は見られませんでした1。神経栄養プロセス82,83塩基性線維芽細胞成長因子(またはFGF-2)は線維芽細胞成長因子ファミリーのメンバーであり、対照群よりもうつ病の方が高いようです84。しかし、報告には一貫性がありません。 このタンパク質は健康な対照よりもMDDが低いが、抗うつ薬治療とともにさらに減少することがわかった85。
うつ病で十分に調査されていないさらなる成長因子には、VEGFと相乗的に作用するチロシンキナーゼ2および可溶性fms様チロシンキナーゼ-1(sVEGFR-1とも呼ばれる)が含まれ、チロシンキナーゼ受容体(BDNFに結合する)は減弱する可能性があります胎盤成長因子もVEGFファミリーの一部ですが、私たちの知る限り、体系的に抑制されたサンプルでは研究されていません。
うつ病における代謝バイオマーカーの所見
代謝性疾患に関連する主なバイオマーカーには、レプチン、アディポネクチン、グレリン、トリグリセリド、高密度リポタンパク質(HDL)、グルコース、インスリン、およびアルブミンが含まれます87。末梢の対照よりも、うつ病治療または寛解とともに増加する可能性があります。 少量ではあるが、うつ病ではインスリン抵抗性が増加する可能性がある88。HDLコレステロールを含む脂質プロファイルは、併存する身体的疾患のない患者を含む多くのうつ病患者で変化しているように見えるが、この関係は複雑であり、さらなる解明が必要である89。うつ病における高血糖90および低アルブミン血症91がレビューで報告されています。
精神障害の強力な生化学的特徴を見つけることを期待して、小分子のメタボロミクスパネルを使用して、全体的な代謝状態の調査がより頻繁になっています。 人工知能モデリングを使用した最近の研究では、グルコース-脂質シグナル伝達の増加を示す一連の代謝物は、MDD診断を高度に予測していました94。
うつ病における神経伝達物質の所見
うつ病のモノアミンに注意を払うことで比較的成功した治療が得られましたが、抗うつ薬のモノアミン標的の選択性に基づいて治療を最適化する強力な神経伝達物質マーカーは特定されていません。 最近の研究は、セロトニン(5-ヒドロキシトリプタミン)1A受容体がうつ病の診断と予後の両方に潜在的に重要であると指摘しており、新しい遺伝子技術と画像技術が保留されています96。 たとえば、5-ヒドロキシトリプトファンの徐放投与を使用します5。ドーパミンの伝達の増加は、他の神経伝達物質と相互作用して、意思決定や動機付けなどの認知結果を改善します97。同様に、神経伝達物質であるグルタメート、ノルアドレナリン、ヒスタミン、およびセロトニンは相互作用して活性化する可能性がありますうつ病関連のストレス反応の一部として; これにより、「フラッディング」による98-ヒドロキシトリプタミンの生成が減少する可能性があります。 最近のレビューはこの理論を示しており、TRDでは、複数の神経伝達物質を標的とするマルチモーダル治療によってこれを逆転させる(そして5-HTを回復させる)ことができることを示唆しています5。 、ノルアドレナリンの99-メトキシ-100-ヒドロキシフェニルグリコール、またはドーパミンのホモバニル酸などの神経伝達物質代謝物は、抗うつ薬治療によるうつ病の減少とともに増加することがしばしば見出されています3、またはこれらの代謝物の低レベルは、 SSRI治療。4
うつ病における神経内分泌所見
コルチゾールは、うつ病で研究されている最も一般的なHPA軸バイオマーカーです。 多数のレビューがHPA活動のさまざまな評価に焦点を合わせています。 全体として、これらは、うつ病が高コルチゾール血症と関連しており、コルチゾール覚醒反応がしばしば減弱することを示唆しています。さらに、特に、コルチゾールレベルの上昇は、心理的治療104,105および抗うつ病106治療に対する反応の低下を予測する可能性があります。 歴史的に、前向き治療反応の最も有望な神経内分泌マーカーはデキサメタゾン抑制試験であり、デキサメタゾン投与後のコルチゾール非抑制はその後の寛解の可能性が低いことに関連しています。 ただし、この現象は、臨床応用のために十分に堅牢であるとは見なされていません。 関連するマーカーであるコルチコトロピン放出ホルモンと副腎皮質刺激ホルモン、およびバソプレッシンは、うつ病で過剰産生されることが一貫して見られず、デヒドロエピアンドロステロンが弱毒化されることが見出されています。 デヒドロエピアンドロステロンに対するコルチゾールの比率は、TRDの比較的安定したマーカーとして上昇し、寛解後も持続する可能性があります107。うつ病の治療に成功して正常化する108。
上記の中で、シナプス可塑性に関与し3、抗うつ薬によって修飾される、グリコーゲンシンターゼキナーゼ-3、マイトジェン活性化プロテインキナーゼ、サイクリックアデノシン5?、112?-一リン酸などのシステム全体のシグナル伝達経路を考慮することも重要です。生物学的システムにまたがる潜在的なバイオマーカー候補は、特にニューロイメージングまたは遺伝学を使用して測定されます。 うつ病と非うつ病の集団の間に堅牢で意味のあるゲノムの違いがないことに対応して、ポリジーンスコア113やテロメア長114などの115の新しい遺伝的アプローチがより有用であることが証明される可能性があります。 人気を集めている追加のバイオマーカーは、さまざまな情報源を利用した概日周期または時間生物学的バイオマーカーを調べています。 アクチグラフは、加速度計を介して睡眠と覚醒の活動と休息の客観的な評価を提供でき、アクチグラフデバイスは、露光などの追加の要因をますます測定できます。 これは、一般的に使用される患者の主観的な報告よりも検出に役立つ可能性があり、治療反応の新しい予測因子を提供する可能性があります116,117。
現在の課題
レビューされたこれらのXNUMXつの神経生物学的システムのそれぞれについて、証拠は同様の物語に従います。いくつかの点でうつ病に関連する多くのバイオマーカーが存在します。 これらのマーカーは、複雑でモデル化が難しい方法で相互に関連していることがよくあります。 証拠には一貫性がなく、一部は他の要因のエピフェノメナであり、一部は一部の患者でのみ重要である可能性があります。 バイオマーカーは、さまざまな経路で有用である可能性があります(たとえば、治療に対するその後の反応を予測するもの、特定の治療がより効果的である可能性が高いことを示すもの、または臨床的改善に関係なく介入によって変化するもの)。 精神医学的集団における生物学的評価の一貫性と臨床的適用性を最大化するには、新しい方法が必要です。
バイオマーカーの変動性
時間の経過や状況によるバイオマーカーの変動は、他のタイプ(ゲノミクス)よりも一部のタイプ(プロテオミクスなど)に関係します。 多くの標準化された規範は存在しないか、広く受け入れられていません。 確かに、マーカーに対する環境要因の影響は、多くの場合、すべてを説明することはできない人々の間の遺伝的構成および他の生理学的差異に依存します。 これにより、バイオマーカーの活動の評価、および生物学的異常の特定が、解釈が困難になります。 潜在的なバイオマーカーの数のために、多くは他の関連するマーカーと一緒に広くまたは完全なパネルで測定されていません。
情動障害のある患者の生物学的システム全体でタンパク質レベルを変化させる多くの要因が報告されています。 保管期間や保管条件(一部の化合物の分解を引き起こす可能性がある)などの研究関連の要因に加えて、これらには、測定された時刻、民族性、運動、119食餌(たとえば、ほとんどの血液バイオマーカー研究が行う場合、マイクロバイオーム活動)が含まれます空腹時のサンプルは必要ありません)、120喫煙と薬物使用、121、および健康要因(併存する炎症性、心血管性、またはその他の身体的疾患など)。 たとえば、うつ病ではないが健康な人では、うつ病ではないグループと比較して炎症の亢進が観察されますが、免疫関連の状態が併存しているうつ病の人は、うつ病や病気のない人よりもさらに高いレベルのサイトカインを持っていることがよくあります122。バイオマーカー、うつ病、治療反応の関係に関与している可能性のあるものを以下に概説します。
ストレス。 内分泌反応と免疫反応の両方がストレス(生理学的または心理的)への反応においてよく知られている役割を持っており、生物学的標本収集時の一時的なストレスは、電流によって強調される可能性のある個人間のこの要因のばらつきにもかかわらず、研究研究ではめったに測定されませんうつ病の症状。 急性および慢性の両方の心理的ストレス要因は免疫チャレンジとして機能し、短期および長期の炎症反応を強調します123,124。この発見は、初期のストレスの経験にまで及びます。成人125,126小児期の外傷性体験中、現在うつ病にかかっている子供たちにのみ炎症の亢進が報告されています127。逆に、うつ病と小児期の外傷の病歴のある人は、うつ病とストレスによるHPA軸の変化は、認知機能と相互に関連しているように見えます128。また、うつ病のサブタイプやHPA関連遺伝子の変化もあります129。ストレスは、神経新生130やその他の神経に短期的および長期的な障害を及ぼします。メカニズム131。子供の頃のトラウマがうつ病の成人の生物学的マーカーにどのように影響するかは正確には不明です。 sしかし、幼少期のストレスは、心理的および/または生物学的に増幅される成人期のストレス反応に耐える傾向がある可能性があります。
認知機能。 神経認知機能障害は、薬を飲んでいないMDDでも、情動障害のある人に頻繁に発生します133。認知障害は、治療抵抗性とともに累積的に現れます134。神経生物学的には、HPA軸129と神経栄養システム135がこの関係で重要な役割を果たす可能性があります。 神経伝達物質であるノラドレナリンとドーパミンは、学習や記憶などの認知プロセスに重要である可能性があります136。炎症反応の上昇は、認知機能の低下と関連しており、さまざまなメカニズムを通じて、抑うつエピソード137および寛解における認知機能に影響を与える可能性があります138。 Krogh et al139は、CRPはうつ病の中核症状よりも認知能力に密接に関連していると提案しました。
年齢、性別、BMI。 これまでの証拠では、男性と女性の生物学的差異の有無、および方向性は特に変動していました。 男性と女性の間の神経内分泌ホルモンの変動は、うつ病の感受性と相互作用します140。炎症研究のレビューは、年齢と性別の制御が炎症性サイトカインの患者制御の違いに影響を与えなかったことを報告しました(ただし、IL-6とうつ病との関連は年齢が上がるにつれて減少しましたこれは、炎症が一般に年齢とともに高まるという理論と一致しています)41,141患者と対照の間のVEGFの違いは、若いサンプルを評価する研究で大きくなりますが、性別、BMI、および臨床的要因は、メタ分析レベルでこれらの比較に影響しませんでした77。炎症とうつ病の以前の検査でのBMIの調整の欠如は、これらのグループ間で報告された非常に重要な違いを混乱させるようです41。 weiに関連付けられている可能性がありますghtゲインとより高いBMI、そしてこれらはうつ病の治療抵抗性と関連しているので、これは調べるべき重要な領域です。
薬。 うつ病(横断的および縦断的の両方)における多くのバイオマーカー研究は、不均一性を減らすために、投薬を受けていない参加者のベースライン標本を収集しました。 しかし、これらの評価の多くは、投薬からのウォッシュアウト期間の後に行われ、炎症に異なる影響を及ぼした可能性のある利用可能な広範囲の治療によって悪化する、生理学の残留変化の潜在的に重要な交絡因子を残します。 いくつかの研究は向精神薬を除外しましたが、他の薬の使用は除外していません:特に、経口避妊薬は研究参加者に頻繁に許可され、分析では制御されていません。これは最近、ホルモンとサイトカインのレベルを上げることが示されています143,144。薬物療法は、炎症反応、34,43,49,145、147、108、148 HPA軸、149神経伝達物質、2および神経栄養1活動に影響を及ぼします。 しかし、うつ病の多くの潜在的な治療法は、明確で複雑な薬理学的特性を持っており、現在のデータによって裏付けられた、さまざまな治療法の選択肢の個別の生物学的効果があるかもしれないことを示唆しています。 モノアミン効果に加えて、特定のセロトニン標的薬(すなわち、SSRI)が炎症のTh150シフトを標的にする可能性が高く、ノルアドレナリン作動性抗うつ薬(SNRIなど)がThXNUMXシフトに影響を与えると理論付けられていますXNUMX。バイオマーカーに対する個別または併用薬の効果を決定します。 これらは、治療期間(長期の薬物使用を評価する試験はほとんどない)、サンプルの不均一性、治療への反応による参加者の層別化など、他の要因によって媒介される可能性があります。
不均一性
方法論。 上記で示唆したように、参加者が受けている治療(および組み合わせ)の違い(および以前に受けた治療)は、特にバイオマーカー研究において、研究結果に不均一性をもたらすことになります。 これに加えて、他の多くの設計とサンプルの特性は研究によって異なり、したがって、結果の解釈と帰属の難しさを増大させます。 これらには、バイオマーカー測定パラメーター(例えば、アッセイキット)およびうつ病のマーカーを収集、保存、処理、および分析する方法が含まれます。 Hiles et al141は、炎症に関する文献の不一致のいくつかの原因を調査し、うつ病の診断、BMI、および併存疾患の正確さが、うつ病と非うつ病のグループ間の末梢炎症を評価する上で最も重要であることを発見しました。
クリニカル。 うつ病の集団の広範な不均一性は十分に文書化されており151、研究文献内の対照的な発見への重要な貢献者です。 診断の範囲内でさえ、異常な生物学的プロファイルは、時間の経過とともに安定しない可能性のある個人のサブセットに限定されている可能性があります。 うつ病に苦しむ人々のまとまりのあるサブグループは、心理的要因と生物学的要因の組み合わせによって特定できる可能性があります。 以下では、バイオマーカーの変動性と不均一性がもたらす課題に対処するためにサブグループを探索する可能性について概説します。
うつ病内のサブタイプ
これまでのところ、うつ病エピソードまたは障害内の同種のサブグループは、症状の提示または治療反応性に基づいて患者を確実に区別することができませんでした152。生物学的異常がより顕著であるサブグループの存在は、以前の研究と層状治療への道を触媒する可能性があります。 Kunugi et al153は、うつ病において臨床的に関連するサブタイプを示すさまざまな神経生物学的システムの役割に基づいて、55,56,154,155つの潜在的なサブタイプのセットを提案しました:メランコリー型うつ病を呈する高コルチゾール症、または非定型サブタイプを反映する低コルチゾール症、ドーパミン関連の患者のサブセット無快感症(および、例えば、アリピプラゾールによく反応する可能性がある)および炎症の上昇を特徴とする炎症性サブタイプを顕著に示す。 炎症に焦点を当てた多くの記事は、うつ病内に「炎症性サブタイプ」が存在するケースを特定しています156炎症の上昇の臨床的相関はまだ決定されておらず、どの参加者がこのコホートを構成するかを発見する直接の試みはほとんど行われていません。 非定型うつ病の人はメランコリーサブタイプよりも炎症のレベルが高い可能性があると提案されています37。これはおそらくメランコリーおよび非定型うつ病のサブタイプのHPA軸に関する所見と一致していません。 TRD157または顕著な体性症状を伴ううつ病158も潜在的な炎症性サブタイプとして推定されていますが、神経栄養(睡眠、食欲、性欲喪失)、気分(気分の落ち込み、自殺傾向および過敏性を含む)および認知症状(情動バイアスおよび罪悪感を含む)159,160すべて生物学的プロファイルに関連しているように見えます。 炎症性サブタイプのさらなる潜在的な候補には、病気の行動のような症状158またはメタボリックシンドロームの経験が含まれますXNUMX。
(軽躁)マニアへの傾向は、うつ病に苦しむ患者を生物学的に区別する可能性があります。 証拠は現在、双極性障害が多面的な気分障害のグループであり、双極性副症候性障害が以前に認識されていたよりも一般的に見られることを示唆しています161。診断を修正するための平均時間は162年を超えることが多く163、この遅延はより大きな重症度と全体的な病気のコストを引き起こします164。双極性障害の患者の大多数は最初に109つ以上のうつ病エピソードを示し、単極性うつ病が最も頻繁な誤診であり、単極性うつ病と双極性うつ病を区別する可能性のある要因は、実質的な意味合いを持っています165,166。 ession。 ただし、これらの比較はほとんどなく、サンプルサイズが小さく、有意でない傾向効果が特定されているか、診断によって十分に特徴付けられていない集団が採用されています。 これらの調査では、これらの関係における治療反応性の役割も調べていません。
双極性障害167と治療抵抗性168はどちらも二分構造ではなく、連続体にあるため、サブタイプの特定が難しくなります。 サブタイピングとは別に、うつ病で観察される多くの生物学的異常が他の診断を受けた患者でも同様に見られることは注目に値します。 したがって、経診断検査も潜在的に重要です。
バイオマーカー測定の課題
バイオマーカーの選択。 潜在的に有用な多数のバイオマーカーは、どのマーカーがどのように、そして誰のために関係しているのかを決定する際の心理生物学の課題を提示します。 課題を増やすために、これらのバイオマーカーの比較的少数がうつ病の十分な調査の対象となっており、ほとんどの場合、健康な集団および臨床集団におけるそれらの正確な役割はよく理解されていません。 それにもかかわらず、有望なバイオマーカーパネルを提案するために多くの試みがなされてきた。 Brand et alの強力な可能性を秘めた16セットのマーカーに加えて、27 Lopresti et alは、治療反応を改善する可能性のある酸化ストレスマーカーの追加の広範なセットを概説しています28。 MDDによる検証および複製サンプルにおける生物学的システム(BDNF、コルチゾール、可溶性TNF?受容体II型、alpha1アンチトリプシン、アポリポプロテインCIII、表皮成長因子、ミエロペルオキシダーゼ、プロラクチンおよびレジスチン)。 一度組み合わせると、これらのレベルの複合測定値は、MDDグループと対照グループを80%〜90%の精度で区別することができました169。これらでさえ、この分野のすべての潜在的な候補をカバーするわけではないことを提案します。 証拠ベースと有望な新規マーカーの両方を含む、うつ病の可能性のあるバイオマーカーの非網羅的な描写については、表2を参照してください。
技術。 技術の進歩により、以前よりも低コストで高感度で多数のバイオマーカーを同時に測定できるようになりました(実際、便利です)。 現在、多数の化合物を測定するこの機能は、データを効果的に分析および解釈する機能よりも進んでいます170。これは、メタボロミクスなどのバイオマーカーアレイや新しいマーカーの増加に伴います。 これは主に、マーカーの正確な役割と相互関係についての理解の欠如、および関連するマーカーが個人内および個人間のさまざまな生物学的レベル(たとえば、遺伝子、転写、タンパク質)間でどのように関連するかについての不十分な把握によるものです。 新しい分析アプローチと標準を使用したビッグデータは、これに対処するのに役立ち、新しい方法論が提案されています。 一例として、フラックスベースの分析に基づいた統計的アプローチの開発があり、ネットワーク間の反応に基づいて新しい潜在的な代謝マーカーを発見し、遺伝子発現を代謝物データと統合します。171機械学習技術はすでに適用されており、バイオマーカーを使用したモデルを支援します。ビッグデータを用いた研究で治療結果を予測するためのデータ172
バイオマーカーの集約。 一連のバイオマーカーを同時に検査することは、生物学的システムまたはネットワークの複雑なウェブへのより正確な視点を提供できる孤立したマーカーを検査する代わりになります26。相互作用はよく理解されています)、バイオマーカーデータを集約またはインデックス化できます。 109,173つの課題は、これを実行するための最適な方法を特定することであり、テクノロジーの強化や新しい分析技術が必要になる場合があります(「ビッグデータ」のセクションを参照)。 歴史的に、174つの異なるバイオマーカー間の比率は興味深い発見をもたらしました43。炎症性サイトカインネットワークの主成分分析を使用するものなど、より大規模なバイオマーカーデータを集約する試みはほとんど行われていません80。メタアナリシスでは、炎症性サイトカインは各研究の単一効果サイズスコアに変換され、全体として、抗うつ薬治療前に有意に高い炎症を示し、外来患者の研究におけるその後の無反応を予測しました。 複合バイオマーカーパネルは、治療結果を改善するために適用できる有意義で信頼できる所見を特定するための将来の研究にとっての課題であり機会でもあります169。以前の研究でうつ病の人と対照群の間で異なることが示され、これらをXNUMXつの独立したサンプルとXNUMX%を超える感度と特異性を持つ対照群で異なるリスクスコアに合成したHPA軸と代謝システム)XNUMX。
ビッグデータ。 ビッグデータの使用は、不均一性、バイオマーカーの変動性を取り巻く現在の課題に対処し、最適なマーカーを特定し、うつ病の翻訳応用研究にフィールドをもたらすためにおそらく必要です。 ただし、上記で概説したように、これは技術的および科学的な課題をもたらします175。健康科学は、ビジネス部門よりも152年ほど遅れて、ビッグデータ分析の使用を開始したのはごく最近のことです。 しかし、iSPOT-D176などの研究や精神医学コンソーシアム5,000などのコンソーシアムは、精神医学における生物学的メカニズムの理解とともに進んでいます。 機械学習アルゴリズムは、ごくわずかな研究で、うつ病のバイオマーカーに適用され始めています。最近の調査では、250のバイオマーカーの21人を超える参加者からのデータがプールされました。 データを複数回代入した後、機械学習によるブースト回帰が実行され、177の潜在的なバイオマーカーが示されました。 さらに回帰分析を行った後、抑うつ症状(赤血球サイズ、血清グルコース、ビリルビンレベルの変動が大きい)と最も強く関連するXNUMXつのバイオマーカーを選択しました。 著者らは、ビッグデータを効果的に使用して仮説を立てることができると結論付けていますXNUMX。より大規模なバイオマーカー表現型プロジェクトが現在進行中であり、うつ病の神経生物学の未来への旅を前進させるのに役立ちます。
今後の展望
バイオマーカーパネルの識別
これまでの文献の調査結果は、大規模な研究で複製する必要があります。 これは、ケモカイン胸腺や活性化調節ケモカイン、成長因子チロシンキナーゼ2などの新規バイオマーカーに特に当てはまります。これらは、私たちの知る限り、臨床的に鬱病で健康な対照サンプルでは調査されていません。 ビッグデータ研究では、包括的なバイオマーカーパネルを分析し、高度な分析手法を使用して、マーカーと、臨床および非臨床集団でマーカーを変更する要因との関係を完全に確認する必要があります。 さらに、主成分分析の大規模な複製は、バイオマーカーの高度に相関するグループを確立する可能性があり、生物学的精神医学における「複合材料」の使用を通知する可能性もあり、将来の発見の均一性を高める可能性があります。
同種のサブタイプの発見
バイオマーカーの選択に関しては、研究が関係する可能性のあるさまざまな潜在的な経路に対して、複数のパネルが必要になる場合があります。 まとめると、現在の証拠は、バイオマーカーのプロファイルが確実に変化しているが、現在うつ病に苦しんでいる個人の亜集団ではひどく変化していることを示しています。 これは、診断カテゴリー内または診断カテゴリー間で確立される可能性があり、この文献で観察できる所見のいくつかの矛盾を説明します。 生物学的サブグループ(または複数のサブグループ)の定量化は、うつ病のバイオマーカーネットワークパネルの大規模なクラスター分析によって最も効果的に促進される可能性があります。 これは、母集団内の変動性を示しています。 潜在クラス分析は、たとえば炎症に基づいて、明確な臨床的特徴を示す可能性があります。
炎症と反応に対する特定の治療効果
うつ病に対して一般的に処方されているすべての治療法は、特定の生物学的効果について包括的に評価する必要があり、治療試験の有効性も考慮に入れる必要があります。 これにより、バイオマーカーと症状の提示に関連する構成要素が、さまざまな抗うつ薬治療の結果をより個別化された方法で予測できるようになり、単極性うつ病と双極性うつ病の両方の状況で可能になる可能性があります。 これは、現在示されている治療だけでなく、新しい潜在的な治療にも役立つ可能性があります。
治療反応の前向き決定
上記の手法を使用すると、治療抵抗性を前向きに予測する能力が向上する可能性があります。 治療反応のより本格的で持続的な(例えば、長期的な)測定がこれに寄与する可能性があります。 患者の幸福の他の有効な測定値(生活の質や日常の機能など)の評価は、バイオマーカーとより密接に関連する可能性のある治療結果のより包括的な評価を提供する可能性があります。 生物学的活動だけでは治療反応者と非反応者を区別できないかもしれませんが、心理社会的または人口統計学的変数を持つバイオマーカーの同時測定は、不十分な治療反応の予測モデルを開発する際にバイオマーカー情報と統合できます。 応答を予測するために信頼できるモデルが開発され(抑うつ集団または亜集団のいずれか)、遡及的に検証された場合、翻訳デザインは大規模な対照試験での適用性を確立できます。
層別処理に向けて
現在、うつ病の患者は、最適化された介入プログラムを受けるように体系的に指示されていません。 検証された場合、層化試験デザインを使用してモデルをテストし、無反応を予測したり、段階的ケアモデルで患者をトリアージする必要がある場所を決定したりできます。 これは、さまざまな種類の介入にわたって、標準化された治療設定と自然主義的な治療設定の両方で役立つ可能性があります。 最終的に、臨床的に実行可能なモデルを開発して、個人に最も適切な治療を提供し、難治性うつ病を発症する可能性のある患者を認識し、これらの患者に強化されたケアとモニタリングを提供することができます。 治療抵抗性のリスクがあると特定された患者は、心理的および薬理学的治療の併用または薬物療法の併用を処方される場合があります。 推測的な例として、炎症性サイトカインの上昇がない参加者は、薬理学的治療ではなく心理的治療を受けることが示される可能性がありますが、特に炎症が高い患者のサブセットは、標準治療の増強として抗炎症剤を受け取る可能性があります。 層別化と同様に、個別化された治療選択戦略が将来可能になる可能性があります。 たとえば、特定の落ち込んだ個人は、著しく高いTNFを持っている可能性がありますか? レベルが、他の生物学的異常はなく、TNFによる短期治療の恩恵を受けることができますか? 個別化治療では、治療中にバイオマーカーの発現をモニタリングして、介入の変更の可能性、必要な継続療法の長さを通知したり、再発の早期マーカーを検出したりすることもあります。
新規治療標的
他の医学分野からの新規または再利用された介入を含む、十分に検討されていないうつ病に効果的である可能性のある膨大な数の潜在的な治療法があります。 最も人気のあるターゲットのいくつかは、セレコキシブ(および他のシクロオキシゲナーゼ-2阻害剤)、TNFなどの抗炎症薬にありますか? 拮抗薬のエタネルセプトとインフリキシマブ、ミノサイクリンまたはアスピリン。 これらは有望であるように思われます178。ケトコナゾール179およびメチラポン180を含む抗糖質コルチコイド化合物は、うつ病について調査されていますが、どちらも副作用プロファイルに欠点があり、メチラポンの臨床的可能性は不明です。 ミフェプリストン181とコルチコステロイドのフルドロコルチゾンとスピロノラクトン182、デキサメタゾンとヒドロコルチゾン183も短期的にうつ病の治療に有効である可能性があります。 ケタミンを含むグルタミン酸N-メチル-d-アスパラギン酸受容体拮抗薬を標的とすることは、うつ病の効果的な治療法となる可能性があります184。関連する神経生物学的経路を介して抗うつ効果を発揮する3
このように、抗うつ薬の生化学的効果(「薬」のセクションを参照)は、他の分野、特に胃腸病、神経学的および非特異的症状の病気の臨床的利益のために利用されています188。抗うつ薬の抗炎症効果は、これらの利点。 リチウムはまた、重要なグリコーゲンシンターゼキナーゼ-3経路を介して炎症を軽減することが示唆されています189。これらの効果に焦点を当てることで、うつ病のバイオマーカーの特徴を知ることができ、バイオマーカーは新薬開発の代理マーカーとなる可能性があります。
アレックス・ヒメネスの洞察
うつ病は、活動への興味の喪失など、気分に影響を与える重度の症状を特徴とする精神障害です。 しかし、最近の調査研究では、患者の行動症状だけでなく、うつ病を診断できる可能性があることがわかっています。 研究者によると、うつ病をより正確に診断できる簡単に入手できるバイオマーカーを特定することは、患者の全体的な健康と健康を改善するための基本です。 一例として、臨床所見は、大うつ病性障害(MDD)のある人は、健康な対照よりも血中のアセチル-L-カルニチン(LAC)分子のレベルが低いことを示唆しています。 最終的に、うつ病のバイオマーカーを確立することは、障害を発症するリスクのある人をより適切に判断するのに役立つだけでなく、医療専門家がうつ病の患者に最適な治療オプションを決定するのに役立つ可能性があります。
まとめ
文献によると、うつ病患者の約6分のXNUMXは最初の治療への寛解を達成しておらず、試行された治療の数とともに無反応の可能性が高くなります。 効果のない治療法を提供することは、持続的な苦痛と幸福の欠如、自殺のリスク、生産性の損失、医療資源の浪費など、個人と社会のコストに大きな影響を及ぼします。 うつ病に関する膨大な文献は、うつ病の人々の治療を改善する可能性のある膨大な数のバイオマーカーを示しています。 何十年にもわたって広範な研究の対象となっている神経伝達物質および神経内分泌マーカーに加えて、最近の洞察は、うつ病に重要に関与する炎症反応(およびより一般的には免疫系)、代謝および成長因子を強調しています。 しかし、過度の対照的な証拠は、うつ病の人々の管理とケアを改善するためにバイオマーカー研究を適用する前に取り組む必要のある多くの課題があることを示しています。 生物学的システムは非常に複雑であるため、大規模なサンプルのマーカーの包括的な範囲を同時に検査することは、個人間の生物学的状態と心理的状態の間の相互作用を発見する上で非常に有益です。 神経生物学的パラメーターとうつ病の臨床的測定の両方の測定を最適化することは、より深い理解を促進する可能性があります。 このレビューはまた、うつ病の生物学と治療抵抗性のメカニズムの一貫した理解を収集する上で、潜在的に変更する要因(病気、年齢、認知、投薬など)を調べることの重要性を強調しています。 一部のマーカーは、患者のサブグループにおける特定の治療に対する治療反応または耐性を予測するために最も有望である可能性が高く、生物学的および心理学的データの同時測定は、治療結果が不良であるリスクのある患者を前向きに特定する能力を高める可能性があります。 バイオマーカーパネルの確立は、診断の精度と予後を向上させるだけでなく、うつ病の最も早い実行可能な段階での治療を個別化し、効果的な新しい治療目標を開発するための含意があります。 これらの影響は、うつ病患者のサブグループに限定される可能性があります。 これらの可能性への道筋は、臨床症候群を根底にある神経生物学的基質により密接に結び付ける最近の研究戦略を補完しますXNUMX。 多くの作業が必要ですが、関連するバイオマーカーとうつ病性障害との関係の確立は、個人および社会レベルでのうつ病の負担を軽減するための実質的な意味を持っていることは明らかです。
謝辞
このレポートは、サウスロンドンの国立健康研究所(NIHR)生物医学研究センター、モーズリーNHS財団トラストおよびキングスカレッジロンドンによって資金提供された独立した研究を表しています。 表明された見解は著者の見解であり、必ずしもNHS、NIHR、または保健省の見解ではありません。
脚注
開示。 AHYは、過去3年間に、アストラゼネカ(AZ)、ルンドベック、イーライリリー、サノビオンからの講演で名誉を授与されました。 アラガン、リバノバ、ルンドベック、サノビオン、ヤンセンからのコンサルティングに対する名誉。 Janssenと英国の資金提供機関(NIHR、MRC、Wellcome Trust)からの研究助成金のサポート。 AJCは、過去3年間に、アストラゼネカ(AZ)からの講演で名誉、アラガン、リバノバ、ルンドベックからのコンサルティングで名誉、ルンドベックと英国の資金提供機関(NIHR、MRC、ウェルカムトラスト)から研究助成金の支援を受けています。
著者は、この作業に他の利害の衝突はないと報告しています。
結論として、 多くの調査研究でうつ病の数百のバイオマーカーが見つかりましたが、うつ病の病気における役割や、診断、治療、予後を向上させるために生物学的情報をどのように正確に利用できるかを確立したものは多くありません。 ただし、上記の記事では、他のプロセスに関与するバイオマーカーに関する入手可能な文献をレビューし、臨床所見をうつ病の所見と比較しています。 さらに、うつ病のバイオマーカーに関する新しい発見は、より良い治療をフォローアップするために、うつ病をよりよく診断するのに役立つ可能性があります。 米国国立バイオテクノロジー情報センター(NCBI)から参照されている情報。私たちの情報の範囲は、カイロプラクティックおよび脊椎の損傷と状態に限定されています。 主題について話し合うには、お気軽にジメネス博士に質問するか、までお問い合わせください。915-850-0900 。
アレックス・ヒメネス博士によるキュレーション
その他のトピック:背痛
背中の痛み 障害のための最も一般的な原因の1つであり、世界中の仕事で逃した日です。 事実、背部痛は、医者の診察の第2の理由として挙げられており、上気道感染症の数だけ多い。 人口のおよそ80%は、一生を通して一度は何らかのタイプの腰痛を経験します。 脊椎は、他の軟組織の中で骨、関節、靭帯および筋肉からなる複雑な構造である。 このため、怪我および/または悪化した状態、例えば 椎間板ヘルニア 最終的には、背痛の症状につながる可能性があります。 スポーツ傷害または自動車事故による傷害は、多くの場合、背痛の最も頻繁な原因であるが、時には最も単純な運動は痛い結果をもたらすことがある。 幸運なことに、カイロプラクティックケアのような代替治療の選択肢は、脊柱調節と手作業による腰痛の緩和に役立ち、究極的には疼痛緩和を改善する。
VIDEO
VIDEO













 抽象
抽象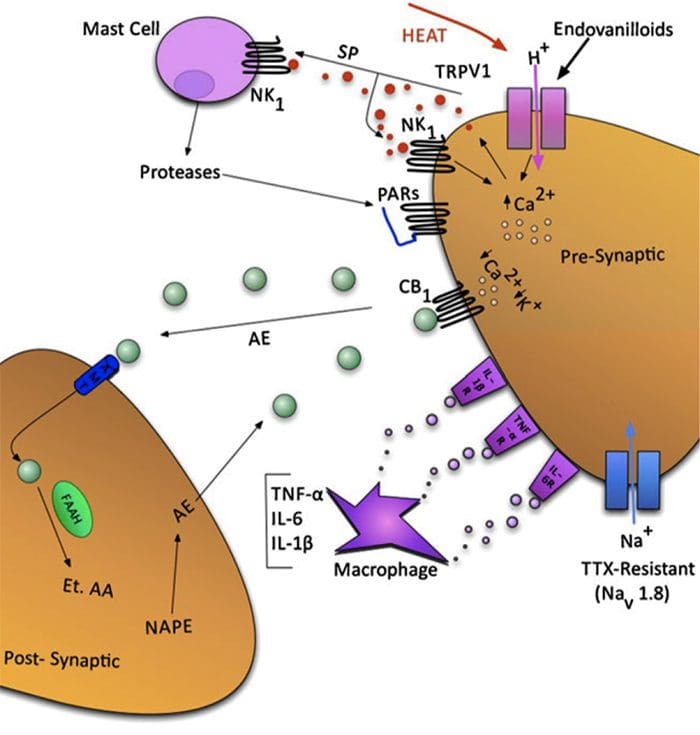


















 参照:
参照:
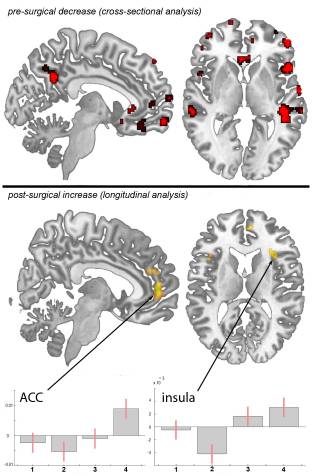
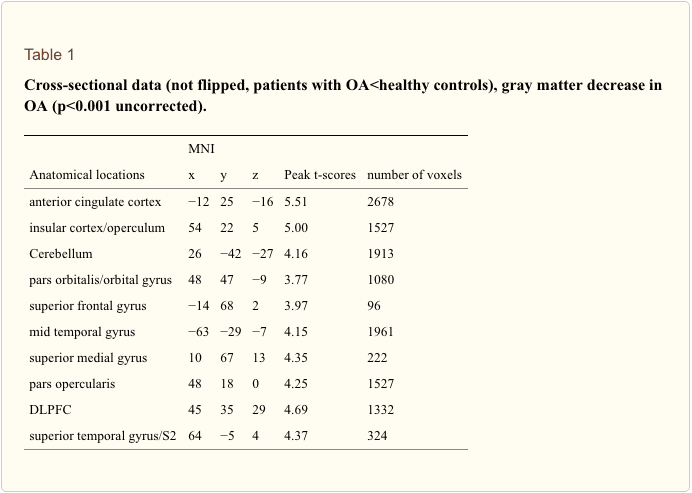
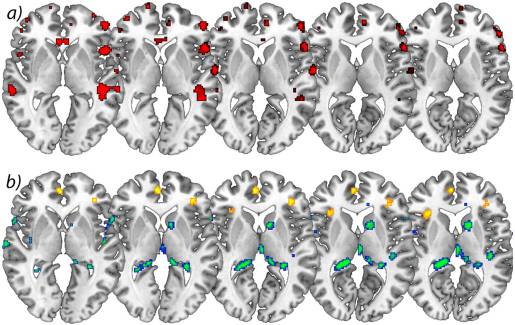
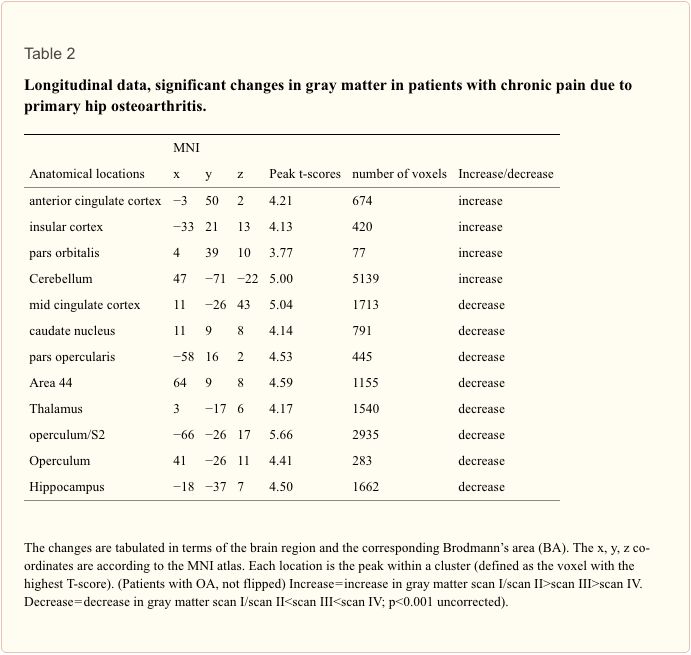

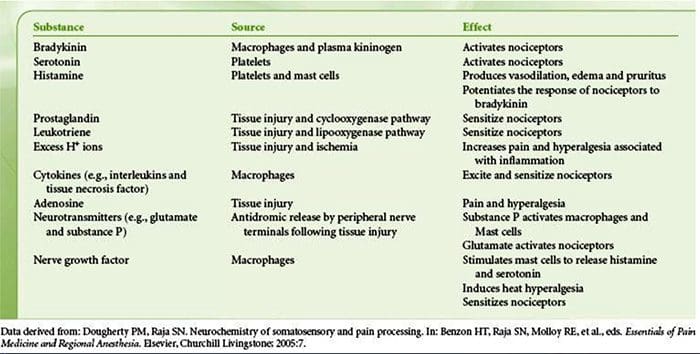
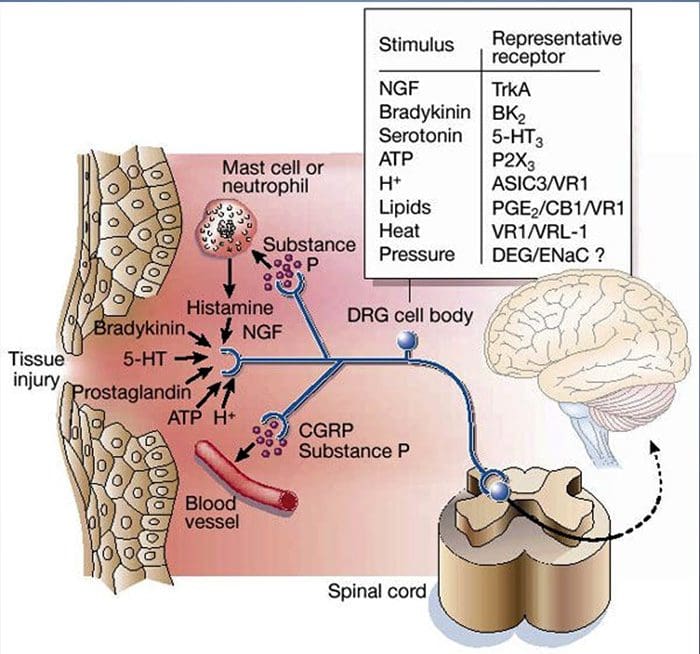
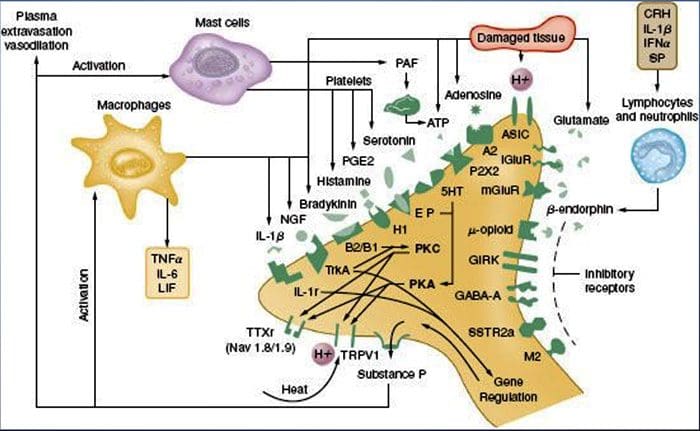 なぜ私の肩が痛いのですか? 肩の痛みの神経解剖学的および生化学的基礎のレビュー
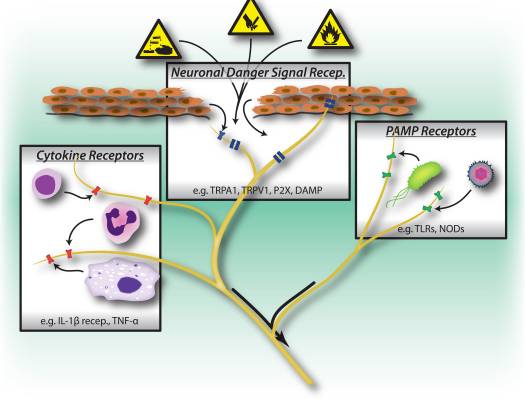
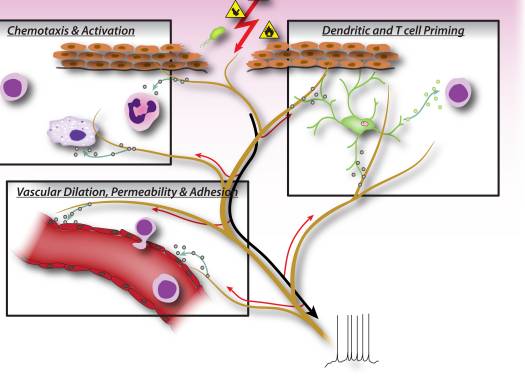
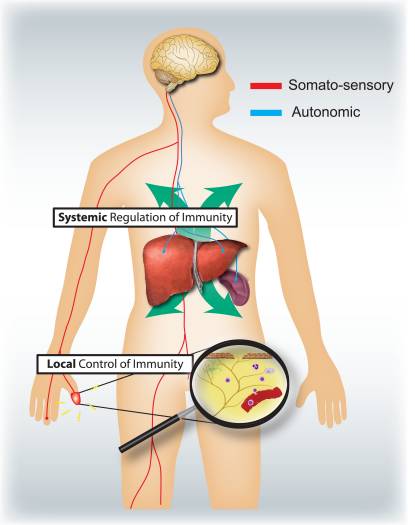
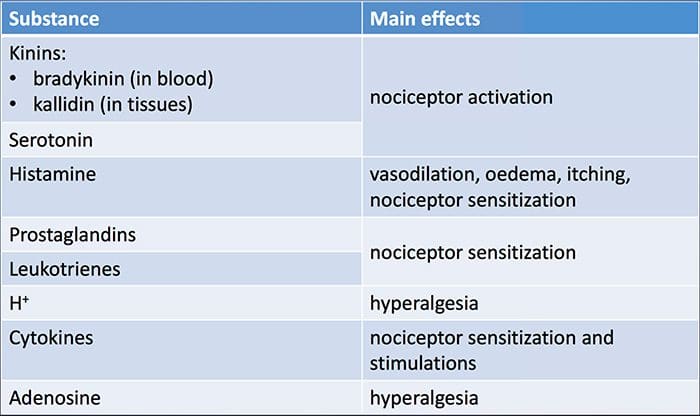
なぜ私の肩が痛いのですか? 肩の痛みの神経解剖学的および生化学的基礎のレビュー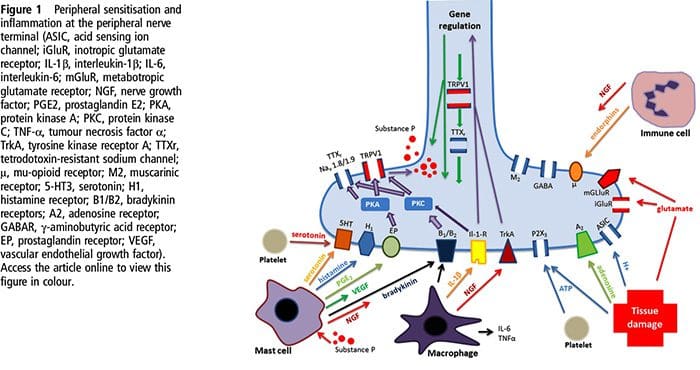 NGFと一過性受容器電位カチオンチャネルサブファミリーVメンバー1(TRPV1)受容体は、炎症と侵害受容器感作に関しては共生関係にあります。 炎症を起こした組織で産生されるサイトカインは、NGF産生の増加をもたらします19。NGFは、肥満細胞によるヒスタミンとセロトニン(5-HT3)の放出を刺激し、侵害受容器を感作し、おそらくAの特性を変化させます。 より多くの割合が侵害受容性になるような繊維。 TRPV1受容体は、一次求心性線維の亜集団に存在し、カプサイシン、熱、およびプロトンによって活性化されます。 TRPV1受容体は求心性線維の細胞体で合成され、末梢および中枢の両方の末端に輸送され、そこで侵害受容性求心性神経の感受性に寄与します。 炎症は末梢でNGF産生を引き起こし、それが侵害受容器末端のチロシンキナーゼ受容体1型受容体に結合し、NGFは細胞体に輸送され、そこでTRPV1転写のアップレギュレーションを引き起こし、その結果、侵害受容器感受性が増加します。19NGFおよび他の炎症性メディエーターも、多様な二次メッセンジャー経路を介してTRPV20を感作します。 コリン作動性受容体、γ-アミノ酪酸(GABA)受容体、ソマトスタチン受容体を含む他の多くの受容体も、末梢侵害受容体感受性に関与していると考えられています。
NGFと一過性受容器電位カチオンチャネルサブファミリーVメンバー1(TRPV1)受容体は、炎症と侵害受容器感作に関しては共生関係にあります。 炎症を起こした組織で産生されるサイトカインは、NGF産生の増加をもたらします19。NGFは、肥満細胞によるヒスタミンとセロトニン(5-HT3)の放出を刺激し、侵害受容器を感作し、おそらくAの特性を変化させます。 より多くの割合が侵害受容性になるような繊維。 TRPV1受容体は、一次求心性線維の亜集団に存在し、カプサイシン、熱、およびプロトンによって活性化されます。 TRPV1受容体は求心性線維の細胞体で合成され、末梢および中枢の両方の末端に輸送され、そこで侵害受容性求心性神経の感受性に寄与します。 炎症は末梢でNGF産生を引き起こし、それが侵害受容器末端のチロシンキナーゼ受容体1型受容体に結合し、NGFは細胞体に輸送され、そこでTRPV1転写のアップレギュレーションを引き起こし、その結果、侵害受容器感受性が増加します。19NGFおよび他の炎症性メディエーターも、多様な二次メッセンジャー経路を介してTRPV20を感作します。 コリン作動性受容体、γ-アミノ酪酸(GABA)受容体、ソマトスタチン受容体を含む他の多くの受容体も、末梢侵害受容体感受性に関与していると考えられています。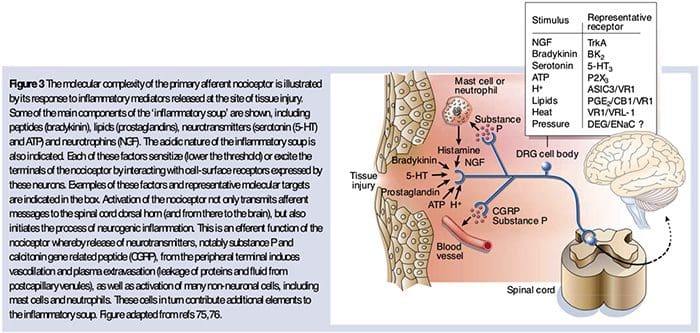 侵害受容器の神経化学
侵害受容器の神経化学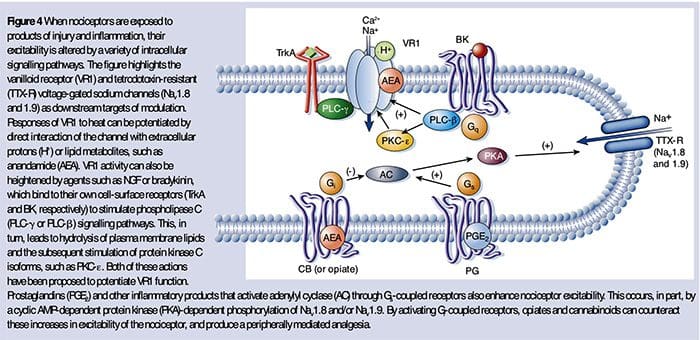 痛みの細胞および分子メカニズム
痛みの細胞および分子メカニズム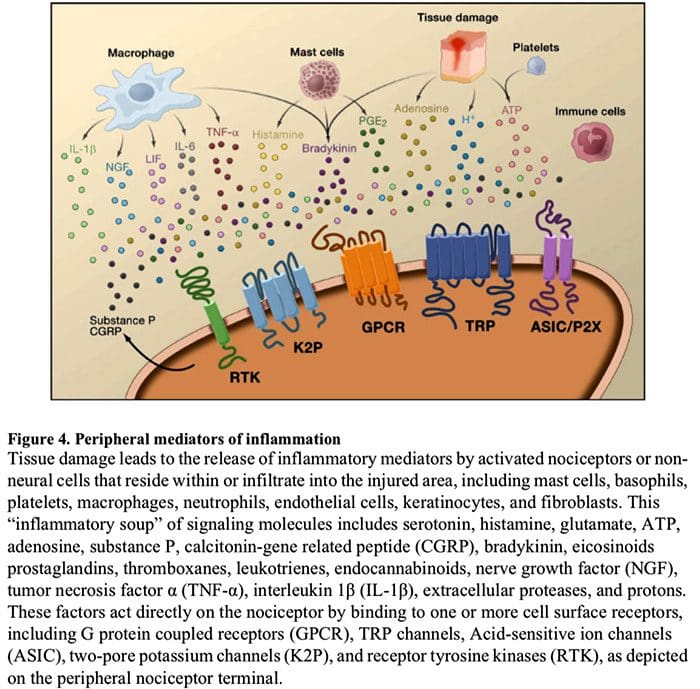
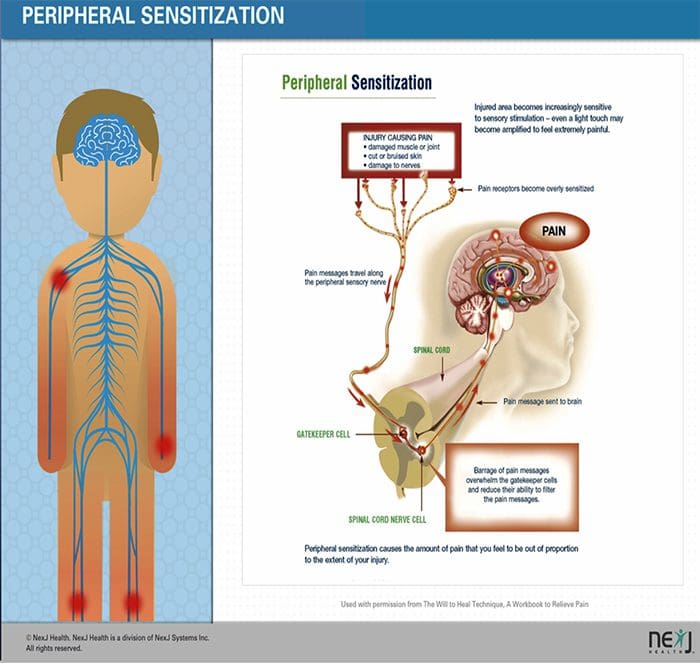
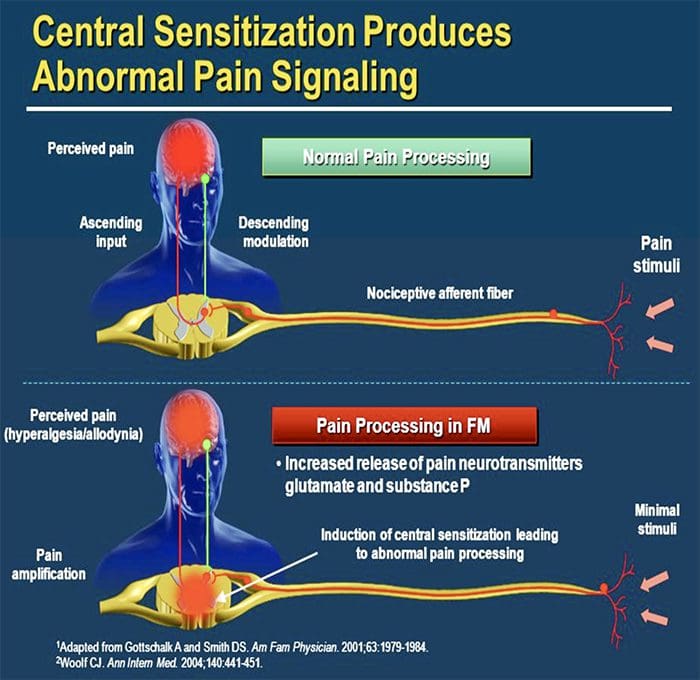
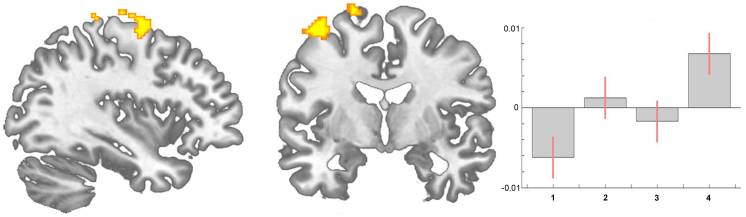
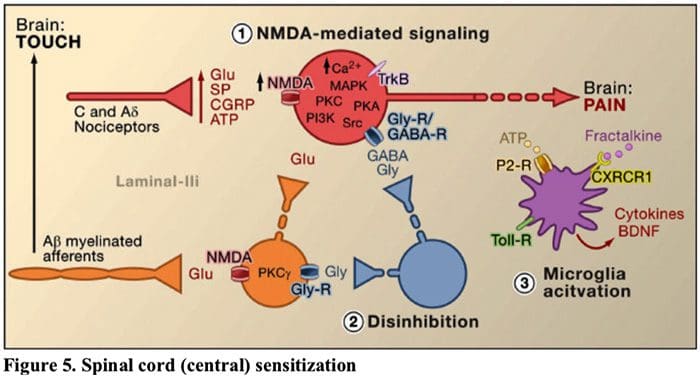 図5.脊髄(中央)感作
図5.脊髄(中央)感作